La thérapie CAR T, une approche innovante pour traiter certains types de cancer, repose sur la modification génétique des cellules immunitaires d'un patient pour cibler et détruire les cellules cancéreuses. Ce processus complexe nécessite des procédures de laboratoire hautement spécialisées, et il est essentiel de donner la priorité à la sécurité des cellules modifiées, du patient et des professionnels de la santé impliqués.
Cet article examine le processus de modification génétique des cellules CAR T, le rôle crucial que joue le contrôle de la contamination et le rôle essentiel de l'équipement de protection individuelle (EPI) dans le maintien d'un environnement sûr.
Le processus de modification génétique des cellules CAR T
1. collecte de cellules T
- Les cellules T sont collectées par leucaphérèse, un processus similaire au don de sang.
- La leucaphérèse permet d'isoler les cellules T des autres composants sanguins.
- Des conditions stériles permettent d'éviter toute contamination à ce stade critique.
2. l'isolement et l'activation
- Les cellules T sont isolées et activées dans un environnement de laboratoire contrôlé.
- Les cellules sont cultivées et préparées pour la modification.
3. les modifications génétiques
- Un gène de récepteur d'antigène chimérique (CAR) est introduit pour permettre le ciblage du cancer.
- Des vecteurs lentiviraux ou rétroviraux sont utilisés pour délivrer le gène en toute sécurité.
- Le contrôle de la contamination garantit l'intégrité des modifications.
4. l'expansion
- Les cellules T modifiées sont étendues à des niveaux thérapeutiques.
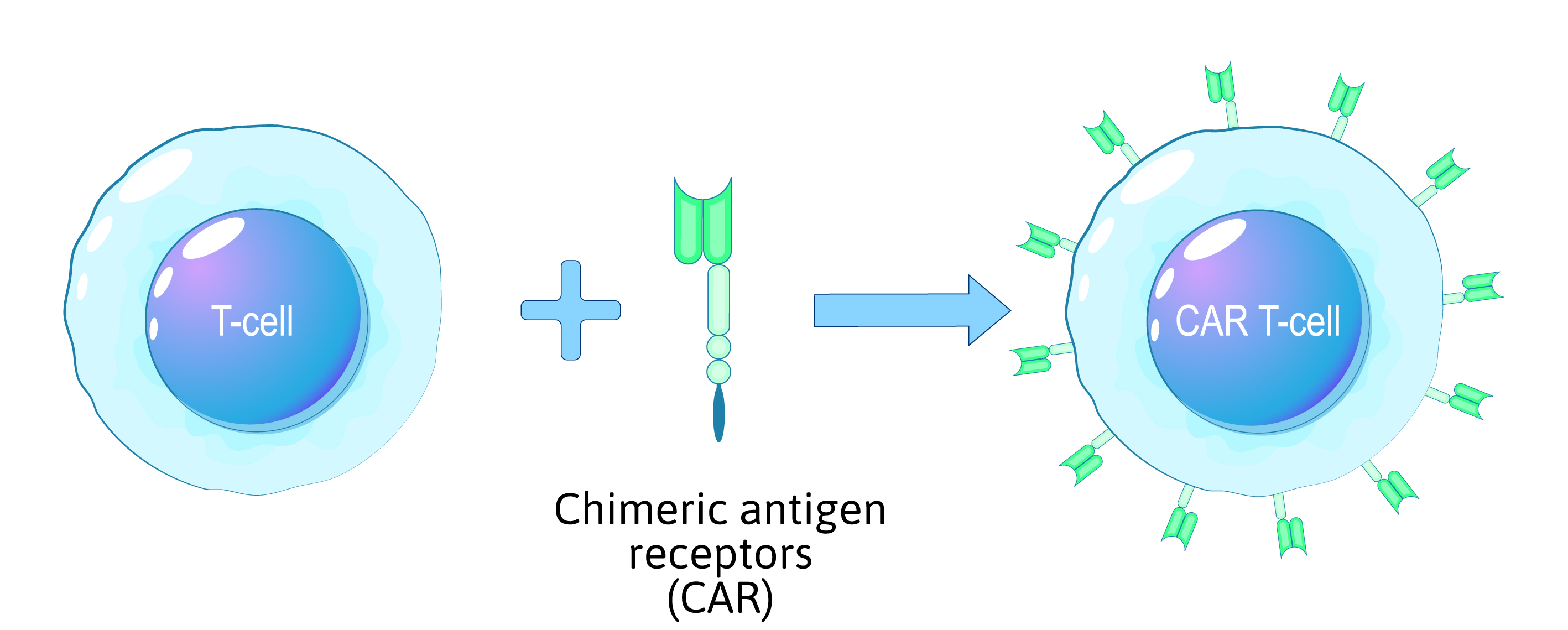 Figure 1 : Vue d'ensemble du processus de reprogrammation des cellules CAR T.
Figure 1 : Vue d'ensemble du processus de reprogrammation des cellules CAR T.
5. le contrôle de la qualité
- La pureté, la viabilité et l'efficacité des cellules sont testées.
- Seules les cellules de la plus haute qualité passent à l'étape suivante.
6. la perfusion dans le patient
- Les cellules CAR T modifiées sont perfusées au patient.
- Cela marque le début d'une réponse immunitaire ciblée contre le cancer.
Mesures de contrôle de la contamination
Un contrôle efficace de la contamination est impératif tout au long du processus de modification génétique des cellules CAR T afin de maintenir l'intégrité de la thérapie et de garantir la sécurité des patients et du personnel de laboratoire. Les principales mesures de contrôle de la contamination sont les suivantes
1) Techniques stériles:
Le personnel de laboratoire doit respecter strictement les techniques stériles, y compris le lavage des mains, le port de la blouse et des gants, afin de s'assurer que tous les équipements et matériels utilisés sont stériles.
2. Cabinets de sécurité biologique (BSC):
La modification génétique des cellules a lieu dans des enceintes de sécurité biologique de classe II, qui offrent un environnement contrôlé et stérile. Ces armoires permettent de contenir les contaminants potentiels et de protéger le personnel de laboratoire.
3. Installations de salles blanches:
La production de cellules CAR T a souvent lieu dans des salles blanches de classe ISO, spécialement conçues pour maintenir des niveaux élevés de propreté et contrôler la contamination particulaire.
4. les barrières d'isolement:
Les barrières d'isolement physique, telles que les hottes à flux laminaire et les systèmes fermés, sont utilisées pour prévenir la contamination pendant les processus de manipulation et de culture des cellules.
5. Contrôle de routine:
Il est essentiel de contrôler régulièrement la qualité de l'air, la contamination des surfaces et la présence microbienne dans les laboratoires afin d'identifier les sources potentielles de contamination et d'y remédier rapidement. Les outils de surveillance les plus courants sont les compteurs de particules et les échantillonneurs microbiens.
6. Élimination des déchets:
L'élimination correcte des déchets, y compris des équipements potentiellement contaminés et des déchets biologiques, est essentielle pour prévenir la contamination. L'élimination du matériel contaminé, y compris les objets tranchants, est essentielle pour éviter toute exposition accidentelle du personnel.


